アルファウイルスRNAレプリコンはウイルス様小胞を生じ、その感染力は自律的進化により1000倍にも増加した
PNASに掲載された論文から
自己増殖型mRNAワクチンであるレプリコンワクチンは、細胞内でmRNAが増殖するという機序を持ちます。mRNAの増殖が細胞内だけに間違いなく留まるのであればリスクは限定的かもしれませんが、そうとは限りません。なぜなら、エクソソームなどの細胞外小胞によってmRNAが細胞外に分泌される仕組みがあるからです。また、mRNAの配列は増殖の際に不変でもありません。本来RNA複製の変異率は高く、RNAが増殖の過程で「進化」し得るからです。
キャプシド (またはカプシド) とはウイルスのゲノムを取り囲む「殻」の事ですが、レプリコンワクチンはキャプシドの遺伝子を持っていません。では、レプリコンワクチンがウイルス様の粒子を作る恐れはないのでしょうか?
RNAレプリコンが感染性ウイルス様小胞 (virus-like vesicles, VLV) を産生する現象をRoseのグループが発見したのは1994年の事です (Rolles et al. 1994)。アルファウイルスRNAレプリコンに水胞性口炎ウイルスの糖タンパク (VSV G) を発現させるとVLVを産生し、なおかつ細胞間で感染できたのです。しかしながら、キャプシドを持たないVLVが生成されるメカニズムに関してはそれから20年間も謎のままでした。今回はその後同じグループがその機序を解明した2014年の研究を紹介させていただきます。しかもこの研究では、VLVが試験管内の培養の過程で自律的に進化し、感染力が1000倍にも増加したのです。
In vitro evolution of high-titer, virus-like vesicles containing a single structural protein
Rose et al. (2014) Proc Natl Acad Sci USA
高力価のウイルス様小胞の試験管内進化:単一の構造タンパクを含む
自己増殖性で感染性を持つウイルス様小胞 (virus-like vesicles, VLV) は、アルファウイルスRNAレプリコンが唯一の構造タンパクとして水胞性口炎ウイルス糖タンパク(VSV G) を発現する事により生成される。このキャプシドタンパクを持たないVLVが生成されるメカニズムは、20年以上も謎のままであった。我々は、VLVがVSV Gタンパクを含む膜で包まれたRNA複製工場 (spherule) から生じ、それが主に細胞表面に捕捉されるという証拠を示す。VLVは、広範な継代培養の後、非構造複製酵素タンパクにおける複数の点変異の獲得により高力価まで増殖する。我々は高力価VLVを回収できるプラスミドベースのシステムにこれらの突然変異を再構成した。これらの突然変異の1つは、高力価VLVの生産に不可欠な後期ドメインモチーフ(PTAP)を生成する。我々は、多くのエンベロープウイルスが乗っ取る細胞出芽経路をVLVが利用して進化し、細胞表面から効率的に出芽するようになったというモデルを提示する。我々の結果は、キャプシドタンパクを持たない原始的なRNAウイルスが用いていた可能性のある増殖の基本的なメカニズムを示唆している。RNAのより効率的なパッケージング、ウイルスの安定性の向上、自然免疫の回避を可能にするために、後にキャプシドが進化したのかもしれない。
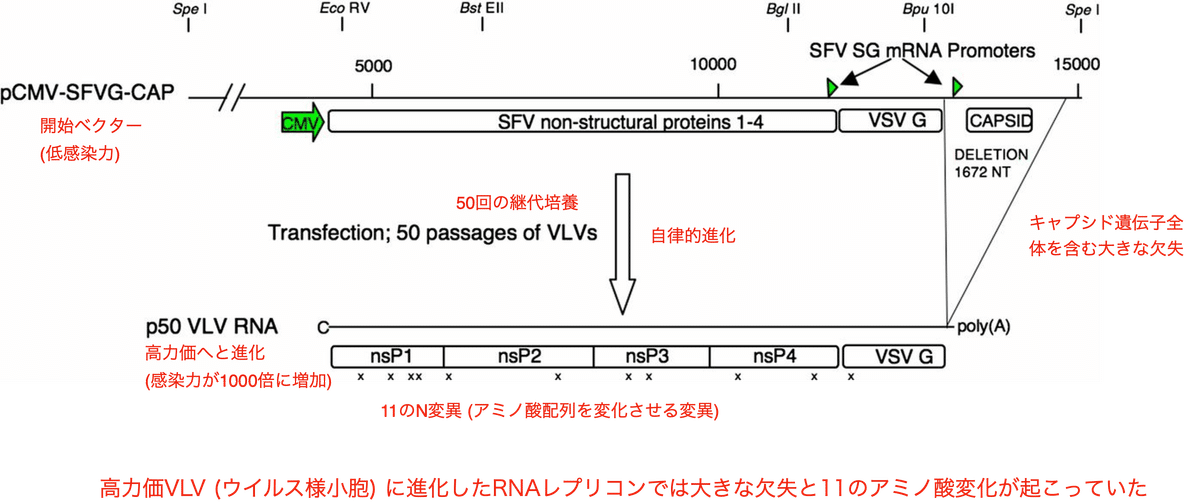
研究で使用されたレプリコンは、プラス鎖RNAのアルファウイルスであるセムリキ森林ウイルス (Semliki Forest Virus, SFV) に由来します。この研究でのアルファウイルスRNAレプリコンは、プラスミドベクターからmRNAへの転写によって作られました。SFVレプリコンRNAは、第1のサブゲノムプロモーターからVSV Gを、第2のプロモーターからSFVキャプシドタンパクを発現します (図1上)。このレプリコンは感染性のウイルス様粒子 (VLV) を生じますが、その力価は低いものでした (〜10⁵ iu (感染単位)/ml)。
細胞から放出されたVLVは培地に含まれるのですが、筆者らはVLVの継代培養を続けるために、このレプリコンをBHK細胞にトランスフェクションした後、その培地を新しいBHK細胞の培養プレートに植え継ぎ、細胞への感染を繰り返しました。結果、8回目の継代までにSFVキャプシドドタンパクの発現は消失し、さらに継代を続けると感染力価が上昇し、細胞変性作用 (CPE) も強化されました。そして、50回目の継代後のプラークから採取されたクローン (p50 VLV) は力価が約10⁸ pfu/mlまで上昇していました。つまり、開始ベクターと比較して感染力が1000倍にも増加したのです。
逆転写およびPCRによってp50 VLVゲノムのコンセンサス配列を解析したところ、2番目のSFVプロモーターを含めてキャプシド遺伝子全体が消失していました (1672ヌクレオチドの欠失) (図1下)。さらに16箇所の一塩基変化があり、そのうち11個がN変異 (アミノ酸配列を変える変異) であり、SFV非構造タンパクの4種類全てとVSV Gにおいてアミノ酸配列の変化が見られました。
プラスミドベクターを再構成し、これらの変異の影響を調べた結果判明したのは、1672ヌクレオチドの欠失はVLV力価の増加にほとんど影響を与えない事、そして高力価には複数の変異の組み合わせが必要であるという事でした。
RNAウイルスの複製中間体は二本鎖RNAを形成するため、細胞内免疫にはこうした二本鎖RNAを認識して攻撃する仕組みが備わっています。プラス鎖RNAウイルスは免疫系の攻撃を避けてRNAを隔離して複製を行うために特殊なコンパートメントを形成しますが、これをスフェルール (spherule) と呼びます。適切な日本語訳が見つからないのですが、sphereとは球体を意味しますので、あえて訳せば「球状構造」となるでしょうか。
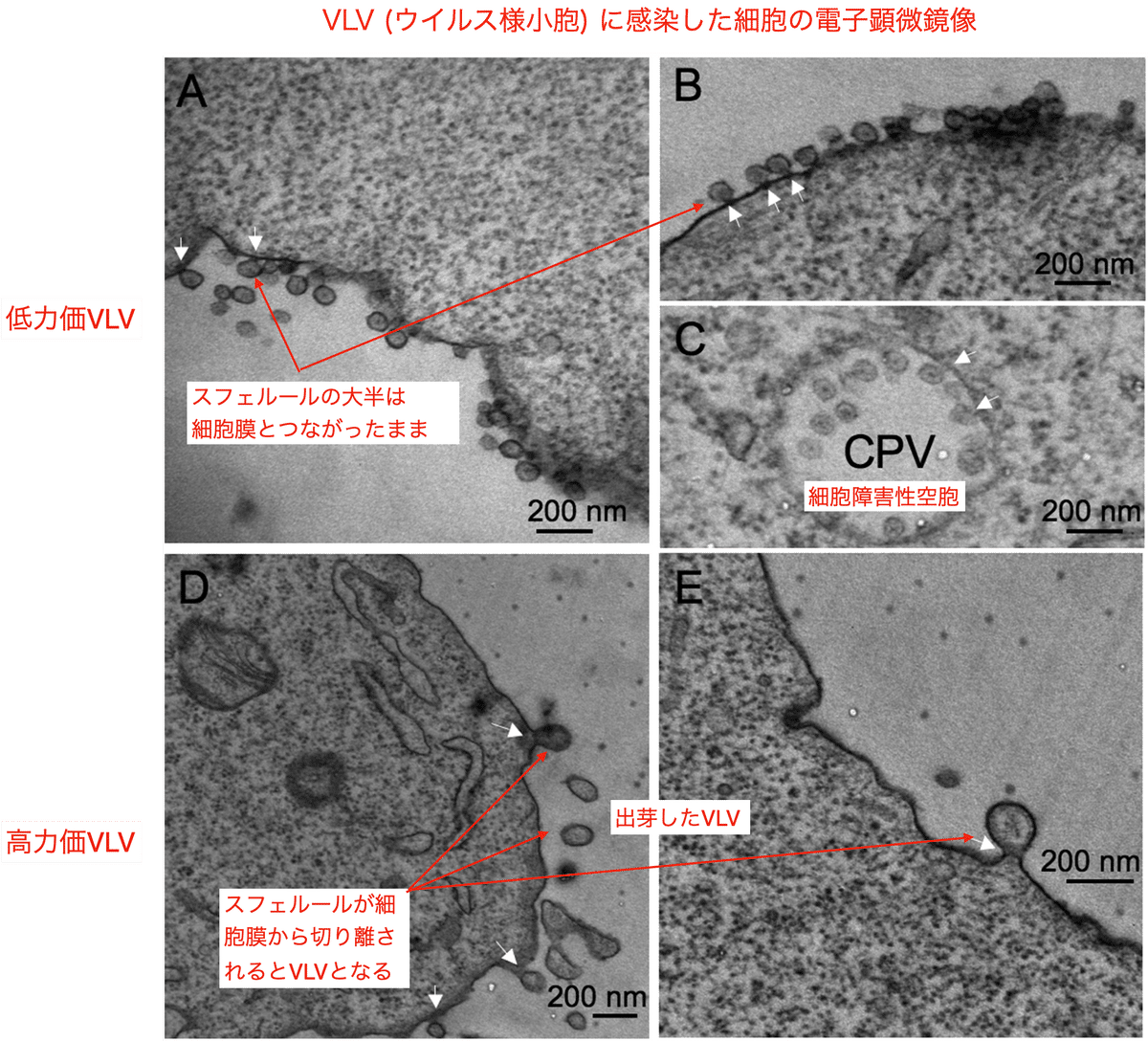
筆者らはVLVがどのように形成されるかを解析するために電子顕微鏡を使ってVLV感染細胞を観察しました。低力価レプリコン (pCMV-SFVG-∆1672 (欠失を含む)) と高力価レプリコン(pCMV-SFVG-p50R (欠失と16点変異を含む)) からVLVが調製され、細胞への感染後7時間で細胞切片が電子顕微鏡によって解析されました (図2)。
低力価VLVで感染した細胞の膜上にはスフェルール (60~70 nm) が散在していますが、それらは細胞膜につながったままです (図2AおよびBの矢印を参照)。また、球状粒子を含む細胞内空胞が時折見られました (図2C) が、これは典型的な細胞障害性空胞 (CPV) と見られます。
対照的に、高力価p50 VLVに感染した細胞では細胞膜とつながったスフェルールは少なく、細胞表面から出芽したと見られる小胞も確認されました (図2DおよびE)。これらの結果から、ほとんどの低力価のVLVは細胞表面に付着したままである一方、高力価のVLVは効率的に出芽したと考えられます。
エンベロープを持つRNAウイルスの多くは、細胞表面からの効率的な出芽のために、宿主細胞が持つ細胞外小胞出芽システムを利用します。 ESCRT複合体 (endosomal sorting complexes required for transport、輸送に必要なエンドソーム内分別複合体) は通常、細胞多胞体 (MVB) への小胞の出芽や、その他の細胞プロセスに関与しています。また、レトロウイルス、パラミクソウイルス、フィロウイルス、ラブドウイルスの出芽はESCRT経路を利用しています。一方、SFVやインフルエンザウイルスを含む他のエンベロープRNAウイルスは、出芽にESCRT経路は用いません。
ESCRTとの会合には構造タンパクの「後期ドメイン」と呼ばれる短い配列モチーフが関与するのですが、レプリコンが高力価VLVへと進化する際にnsP1の変異のうちの1つがこのモチーフを獲得していました (PIAPからPTAPへの変異)。そしてPTAP (またはPSAP) は、ウイルス内部構造タンパクに共通するモチーフですが、実際に変異の再構成実験で確認した結果、このPTAPモチーフへの変異がVLVの高い感染力に深く関わっている事が分かりました。つまり、レプリコンは細胞外小胞の出芽機構をあたかも「ハイジャック」したかの様に自律的に進化し、本来のアルファウイルスとは異なる機序によって高い感染力を獲得していたのです。
図3は、高力価VLVの起源についてのモデルです。VSV GをコードしていないSFVレプリコンは、エンドサイトーシスによって急速に細胞内に取り込まれ細胞障害性空胞 (CPV) に蓄積します。VSV Gをコードする低力価VLVではエンドサイトーシスはVSV Gによって阻害される可能性がある一方、スフェルールの大半は細胞表面につながったままであり、効率的に出芽できません (図3B)。進化したVLVはnsP1タンパク上に複数の変異を保持しており、この中でもPTAPに生じた変異はESCRT経路を「ハイジャック」し、スフェルールを細胞表面から迅速に切断して効率的に出芽するようになったと考えられます (図3C)。
この研究によって明らかになったのは、たとえキャプシドが無くともウイルス様粒子は細胞から出芽し、高い感染力を持つという事です。キャプシドは、RNAのより効率的なパッケージング、ウイルスの安定性の向上、および自然免疫メカニズムによる認識からの防御を可能にしますが、ウイルス進化の初期には必ずしも必要ではなかったのではないでしょうか。
実験では細胞培養の培地を植え継ぐだけのものであるにも関わらず、レプリコンの進化は自律的に (= 自然に、自動的に) 起こっています。これは「試験管内 (in vitro) での人工進化」と言えるのですが、人間の集団の中でレプリコンワクチン接種を繰り返した場合のプロセスにも類似しているのです。進化の原則は「増えやすいものは増えやすい」という単純な同語反復です。つまり、集団内でレプリコンワクチン接種が繰り返されるうちに、ワクチン自体が増えやすく感染しやすいウイルス様粒子へと進化する懸念が払拭できないという事です。
さて、ちなみにこの研究は「ワクチン開発者」による研究であり、むしろ筆者らはワクチンプラットフォームとしてのVLVの開発に前向きで強い関心を寄せています。細胞内で増殖し、しかも高い感染力を持つ自己増殖型のウイルス様小胞の誕生を彼らは大いに「期待」しており、そういった研究を一流紙が採用し発表しているのです。しかしながら、その裏に潜む重大なリスクについては、あるいは意図的にすら見過ごされているのです。このようなワクチン製作者側の思考を我々もじゅうぶん知っておく必要があるでしょう。
マイコメント
こうした研究者たちは自分たちの研究によって人工ウイルスが新たな機能を獲得した
ことを大変喜んでいて、その感染リスクについては全く考えようとしていないことが
わかります。
研究上の実績だけで、その人工ウイルスが1000倍もの感染力を持ったことを喜んで
いて、彼らの研究が学会で評価され賞賛を浴びることを期待しているのでしょう。
まさしくマッドサイエンティストです。
こうした研究は今でも進められていて、彼らは人類がこのウイルスによって甚大な
被害を被ることに一切関心がないのでしょう。



コメント