がんリスクは80代以降むしろ低下する場合がある、その理由が判明
若いマウスと老マウスでは何が違うのか?
いくつかのがんでは、60代や70代よりも80代のほうが発症リスクが低いことが知られています。
この不思議な現象について、これまでは生物学的な説明があまりなく、主に受診率や老衰など他の疾患との関連が中心に語られてきました。
しかし英国ケンブリッジ大学を中心とする研究チームによる最新の研究で、80代以降のがん発症リスク低下を説明できる生物学的メカニズムが示唆されました。
研究者たちは「私たちの結果は、高齢者(80~85歳超)にみられるがん発症率の低下を説明できるかもしれない」と述べています。
しかし、なぜ高齢になるほど、がんを抑制するようなメカニズムが細胞内で働くのでしょうか?
研究内容の詳細は『Nature』にて「老化は鉄の恒常性を再プログラムすることで幹細胞性と腫瘍形成を制限する(Ageing limits stemness and tumorigenesis by reprogramming iron homeostasis)」とのタイトルで掲載されました。
80代以降の高齢で「がんリスク」が低下する場合がある
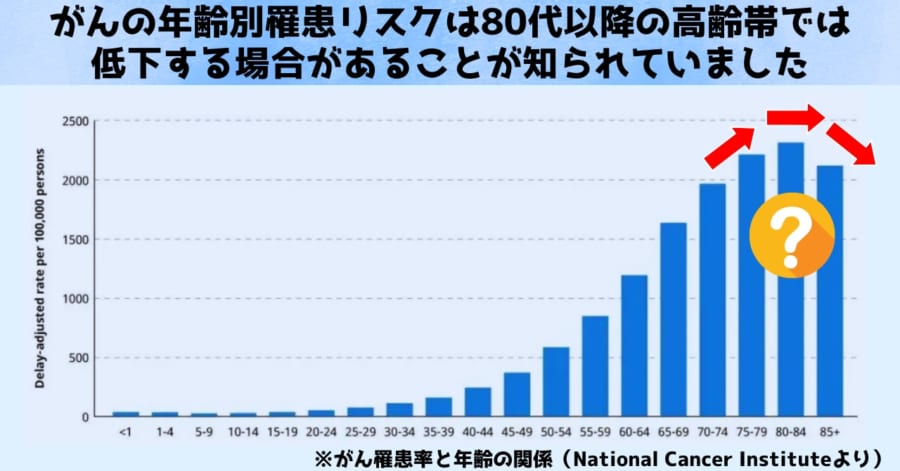
がんは加齢とともに発症リスクが高まる病気として広く知られています。
実際、多くの疫学調査でも、40代や50代に比べると60代から70代でがんと診断されるケースが急増することが示されています。
ところが、こうしたデータをさらに詳しく分析すると、80代以降になると「がんの発症率がむしろ低下する」という興味深い結果が浮かび上がってきます。
たとえば、国や自治体が公表している年齢別・部位別の情報を見ても、70代までは右肩上がりだったグラフが、80歳を超えたあたりから横ばい、もしくはやや下降するパターンがしばしば報告されているのです。
この傾向は、医療の進歩や検診受診率の変化だけでは十分には説明しきれず、長らく“謎”の一つとされてきました。
たとえば「他の疾患で先に亡くなる(競合リスク)ために統計上がんが減って見える」という説や、「非常に高齢になると検査を控える傾向があるため、単に“見つかっていない”だけかもしれない」という意見もあります。
しかしながら、それだけでは説明がつかない生物学的な背景が存在する可能性が指摘されてきたのです。
そして近年、「80代を超えると体の中で何らかの生物学的メカニズムががん発症を抑制しているのではないか?」という仮説が注目を集め始めました。
がんは細胞の遺伝子異常が重なって生まれる病気であり、加齢によって細胞の機能が全般的に衰えると同時に、ゲノム異常も蓄積しやすくなると考えられてきました。
にもかかわらず発症率が下がるという事実は、一見すると矛盾した現象とも言えます。
そこで今回、ケンブリッジ大学を含む研究チームはマウス実験により、高齢者ががんになりにくくなる生物学的な要因を探すことにしました。

なぜ高齢になると、がんリスクが下がる場合があるのか?
答えを求めるため、研究者たちはまず幹細胞と鉄の役割に注目しました。
がん研究の分野では、「自己増殖能・分化能を持つ細胞、すなわち幹細胞や前駆細胞が変異を獲得することでがんが生じる」という見方が一般的になっています。
つまり、体内で重要なポジションを持っている“幹細胞性が強い細胞”ががん化することが問題だというわけです。
これまでの研究では、幹細胞のがん化は、長い時間をかけてDNAに損傷や変異が蓄積することや、遺伝子そのものに変化がなくても、遺伝子発現パターンが大きく変化することが原因だと考えられてきました。
(※また遺伝子発現パターンの変動には「エピジェネティックスな変化」と言われており、DNAメチル化やヒストン修飾など、遺伝子の活性を抑えるタグが付与・除去されることで遺伝子が上手く動かなくなる場合があります)
こうした幹細胞での変化は老化に伴って発生し、高齢者の体内にある幹細胞性を低下させます。
つまり高齢者のがんリスク低下の要因として、幹細胞性が低下している可能性が挙げられるわけです。
簡単に言えば「がん細胞の元となる幹細胞自体が“ポンコツ化”すれば、がん細胞もできにくくなる」という理論です。
また鉄と言えば血液中のヘモグロビンを思い浮かべる人が多いかと思いますが、鉄はそれ以外にも細胞内でエネルギー生成やDNA合成、各種酵素反応などに必須のミネラルです。
さらに細胞が盛んに増殖するためには鉄が欠かせませんが、過剰になると細胞死(鉄依存性細胞死:フェロトーシス)を誘発することも知られています。
ある意味で鉄は、細胞のエネルギーや増殖を理解する上で非常に重要な因子です。
がん細胞は膨大なエネルギーを消費して増殖するため、もし高齢者の体内で鉄を上手く使えなくなっているとしたら、がんの増殖も抑えられる可能性があります。
そこで研究者たちは「幹細胞性の低下」と「鉄の利用能力の低下」の両方が、高齢者でのがんリスク低下に寄与しているのではないかと考え、仮説を検証することにしたのです。
がんリスクが80代で減少する理由
「幹細胞性の低下」と「鉄の利用能力低下」が、がんリスクの低下につながっているのか?
この疑問を解明するため、研究チームは遺伝子組み換えによってがんになりやすいマウスを作り、さらにマウスの肺でがん化を引き起こすウイルスを導入する実験を行いました。
具体的には、若いマウス(人間でいう20~30代相当)と高齢マウス(人間の70代後半~80代相当)の両方を比較することで、がん化の過程に違いがあるかどうかを調べたのです。
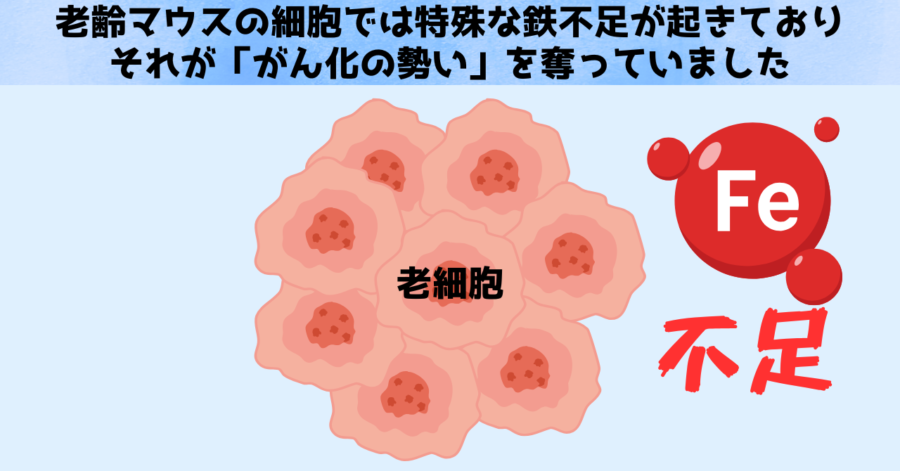
その結果、高齢マウスの肺細胞ではNUPR1という転写因子とリポカリン-2(LCN2)という鉄結合タンパクの発現が劇的に上昇し、それによって細胞の鉄の扱い方が変化し、がん化を抑える方向に働いていることが明らかになりました。
さらに、高齢マウスの細胞では、DNAメチル化などのエピジェネティックな修飾が変化して、これらNUPR1やリポカリン-2を抑えるタグが取り去られて(脱メチル化されて)いたことが分かりました。
研究では、こうした遺伝子の活性化によって、細胞内部の自由な鉄が不足気味になり、細胞増殖や分化を支える仕組みが鈍化していたことがわかりました。
(※実際に、この高齢マウスの肺細胞に鉄を供給したところ、がん化が促進されるという結果も得られました。)
つまり、高齢マウスでは鉄を扱う遺伝子の発現様式が変わり、細胞内の鉄不足が引き起こされることで、幹細胞性が低下し、ひいてはがんリスクも抑えられている可能性があるわけです。
逆を言えば、若いマウスでは鉄を活用できる“元気”な幹細胞が存在し、そのためにがん化が急激に進む背景があると考えられます。
高齢者の場合、がんの進行がゆっくりになると言われていますが、いくつかのがんでは発生率そのものも低下しているのでしょう。
この結果は「高齢になればなるほどがんは増え続ける」という従来の常識に反するものであり、むしろ超高齢期には幹細胞性が弱まることでがん発生が抑制される、というメカニズムが具体的に提示された点で非常に画期的です。
特に「加齢でDNAメチル化が低下する=悪影響ばかり」という単純なイメージに対し、特定のエンハンサーでの脱メチル化がむしろ有利に働く場合もある、という点は重要です。
この新たな発見は、今後のがん予防や抗がん剤の開発において重要な役割を果たすでしょう。
たとえば、「若い世代で早期のがん芽を摘む戦略」 と 「高齢者での幹細胞性低下を加味した治療・ケアの最適化」 は、今後ますます注目されるはずです。
「がん細胞だけを狙うかたちで鉄不足を引き起こす」薬などを開発できれば、効果的ながん治療が実現するかもしれません。




コメント